Способность буферных систем противодействовать резкому изменению рН при добавлении к ним сильной кислоты или основания является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество вносимых в раствор сильной кислоты или щелочи не превышает определенной величины. В противном случае наблюдается резкое изменение рН, т.е. буферное действие раствора прекращается.
Это связано с тем, что в результате протекающей реакции изменяется соотношение молярных концентраций компонентов буферной системы: Скислоты/Ссолиили Соснования/Ссоли.
При этом концентрация компонента, реагирующего с добавленной кислотой или щелочью, уменьшается, а концентрация второго компонента возрастает, т.к. он дополнительно образуется в ходе реакции.
Количественно буферное действие раствора характеризуется с помощью буферной емкости (В). При этом различают буферную емкость по кислоте (Вк.) и буферную емкость по основанию или щелочи (Во.).
Буферной емкостью по кислотеявляется то количество химического эквивалента сильной кислоты, которое нужно добавить к 1 литру (1 дм 3 ) буферной системы, чтобы уменьшить её рН на единицу. Ее можно рассчитать по следующей формуле:
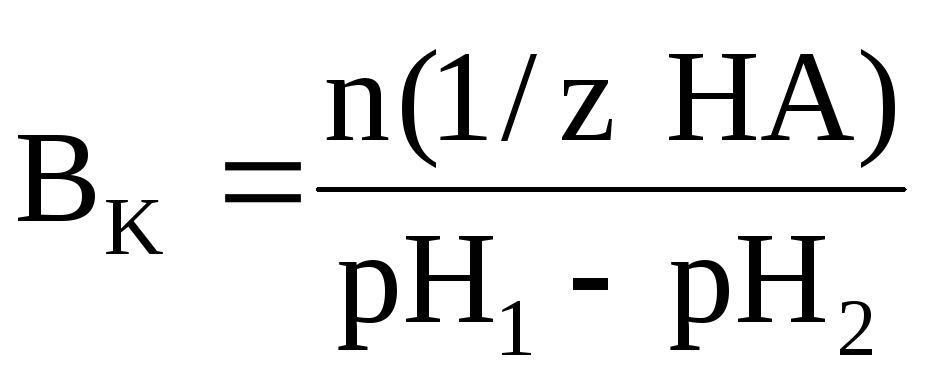
где n(1/z HA) – число молей химического эквивалента сильной кислоты, добавленное к 1 литру буферной системы;рН1 – водородный показатель системы до добавления сильной кислоты;рН2 – водородный показатель системы после добавления сильной кислоты.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем, выраженный в литрах или дм 3 ) формула для подсчета буферной емкости будет иметь следующий вид:
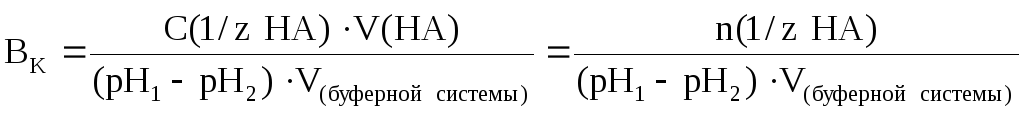
где С(1/z НА) – молярная концентрация химического эквивалента сильной кислоты в добавляемом растворе; V(НА) – объем (л) добавленного раствора сильной кислоты; V(буферной системы) – объем буферного раствора, к которому добавляют раствор кислоты.
Соответственно буферной емкостью по основаниюявляется то количество химического эквивалента сильного основания (щелочи), которое нужно добавить к 1 литру (1 дм 3 ) буферной системы, чтобы вызвать увеличение ее рН на единицу:
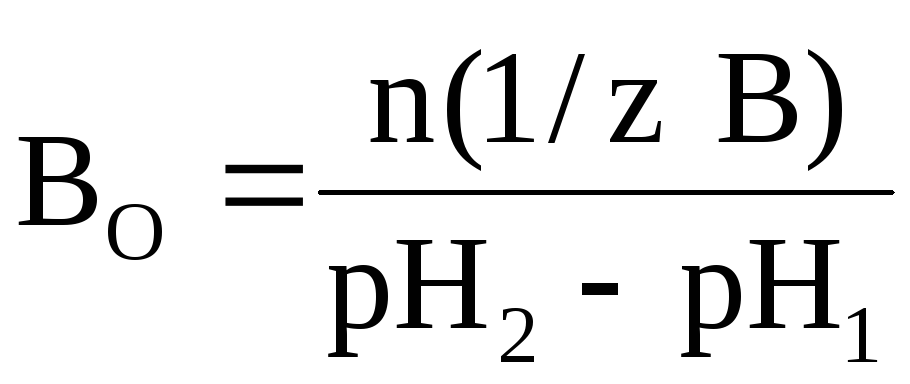
где n(1/z В) – число молей химического эквивалента основания, которое добавили к 1 литру буферного раствора; рН1 – водородный показатель раствора до добавления основания; рН2 – водородный показатель раствора после добавления основания.
В более общем случае (если брать не 1 литр буферной системы, а любой другой ее объем) формула для подсчета буферной емкости по основанию примет следующий вид:
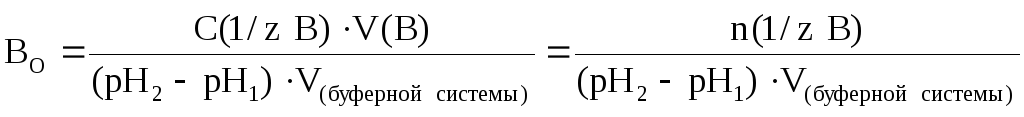
где С(1/z В) – молярная концентрация химического эквивалента основания в добавляемом растворе; V(В) – объем (л) добавленного раствора сильного основания; V(буферной системы) – объем буферного раствора (л), к которому добавляют раствор сильного основания.
Величина буферной емкости зависит от концентраций компонентов буферной системы и от их соотношения.
Чем более концентрированным является буферный раствор, тем выше его буферная емкость, т.к. в этом случае добавление небольших количеств сильной кислоты или щелочи не вызовет существенного изменения концентраций его компонентов, а значит и их соотношения.
Из буферных растворов с одинаковым суммарным содержанием химического количества их компонентов наибольшей емкостью будут обладать те, которые составлены из равного числа молей слабой кислоты и её соли или слабого основания и его соли (рис. 35). В таких растворах молярные концентрации компонентов будут одинаковые, а значит соотношение Скислоты/Ссоли= 1 и Соснования/ Ссоли.= 1.
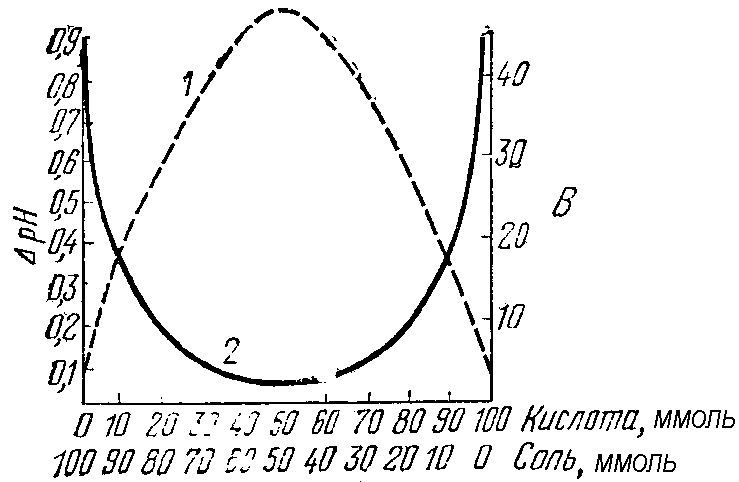
Рис. 35 Изменение буферной емкости (1) и изменение рН кислотной буферной системы при добавлении к ней определенного количества сильной кислоты (2) в зависимости от содержания её компонентов
Данные растворы будут иметь примерно одинаковые значения буферной емкости как по кислоте, так и по основанию.
Если же соотношение концентраций компонентов буферной системы не равно 1, то значения ее буферной емкости по основанию и кислоте будут отличаться друг от друга (причем тем существеннее, чем в большей степени соотношение Скислоты/Ссолии Соснования/Ссолиотклоняется от единицы).
Например, если в кислотной буферной системе солевой компоненты содержится больше чем слабой кислоты, то ее буферная емкость по кислоте будет выше чем по основанию, т.е. Вк.> Во.
Соответственно буферная емкость по кислоте для основной буферной системы будет больше чем по основанию в том случае, если содержание солевой компоненты в этом случае будет меньше чем слабого основания.
Таким образом можно сделать вывод, что в данных случаях буферная емкость выше по тому веществу, которое реагирует с избыточным компонентом буферного раствора.
Если буферная система не обладает достаточной буферной емкостью, то ее можно повысить, увеличив концентрацию обоих компонентов в необходимое количество раз.
Читайте также:
- A) емкость шара
- Активное сопротивление, индуктивность, емкость
- Длительность и трудоемкость обыска делают также весьма желательным наличие у следователя психологической и физической выносливости.
- Емкость полимерная для кровезаменителей со встроенной системой переливания
- Емкость полимерная для кровезаменителей со встроенной системой переливания
- Емкость полимерная для кровезаменителей со встроенной системой переливания.
- Емкость рынка — количество (стоимость) товаров, которое может поглотить рынок при определенных условиях за какой-то промежуток времени.
- ИССЛЕДОВАНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ НА ЕМКОСТЬ КОНДЕНСАТОРА И ДИЭЛЕКТРИЧЕСКИЕ ПОТЕРИ В НЕМ
- Конденсатор. Емкость конденсатора. Расчет потенциала в плоском конденсаторе и расчет его емкости.
- Конъюнктура и емкость рынка
- Конъюнктура и емкость рынка
Границы буферного действия
Буферное действие
Механизм буферного действия заключается в том, что частицы сопряженного основания реагируют с ионом H3O + , образуя сопряженную слабую кислоту.
В общем виде: H3O + + A — = H2O + HA
Например, в случае аммиачной буферной системы имеем: H3O + + NH3 = NH4 + + H2O
Ионы же OH — взаимодействуют с сопряженной кислотой, превращая ее в сопряженное слабое основание.
В общем случае: HA + OH — = H2O + A —
В случае той же аммиачной буферной системы: NH4 + + OH — = NH3 + H2O
Границы буферного действия определяются, исходя из значения рК данной буферной системы и отличаются от него в обе стороны не более чем на единицу.
pH = pK ± 1
Буферная емкость является количественной характеристикой буферного раствора. Определяются буферная емкость по кислоте (Вк) и буферная емкость по щелочи (Вщ).
Буферная емкость определяется как количество вещества H3O + (или OH — ) которое надо добавить к 1л данной буферной системы, чтобы его рН изменился на 1. Напомнить студентам, что при добавлении сильной кислоты к буферной системе рН немного уменьшается, а при добавлении щелочи немного увеличивается.
n(H3O + )добавл. n(ОH — )добавл.
Vбуф.р-ра . |ΔpH| Vбуф.р-ра . |ΔpH|
Пример1. Рассмотреть буферные равновесия в буферной системе NH3— NH4Cl
Решение. Соль диссоциирует на ионы практически полностью:
Ион аммония является слабой катионной кислотой:
Аммиак – нейтральное слабое основание, его протолиз записывается так:
Уравнения (1) и (2) представляют собой уравнения буферных равновесий. По принципу Ле Шателье равновесие в обоих процессах сильно смещено влево . По этой причине равновесные концентрации аммиака и иона аммония практически равны их начальным концентрациям.
Расчет рН в буферных системах производится с помощью уравнения Гендерсона- Хассельбальха.
a(сопр.осн-я)
а(сопр. к-ты)
Аммиак – нейтральная молекула и для него коэффициент активности равен 1. Тогда для данной системы уравнение приобретает вид:
Пример 2.Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 — /HPO4 2- )= 7,2.
рН буферного раствора равно: рН = рКа + lg 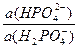
Определяем ионную силу раствора.
0,05 0,05 0,05 ( моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
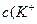 )=
)= 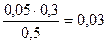 моль/л c(Na
моль/л c(Na 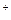 )=
)= 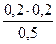 = 0,08моль/л
= 0,08моль/л
c(H2PO4 — )= 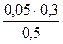 = 0,03 моль/л c(HPO4 2- )=
= 0,03 моль/л c(HPO4 2- )= 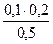 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 ( 0,03·1 2 + 0,03·1 2 + 0,08·1 2 + 0,04·2 2 )= 0,15.
По таблице находим коэффициенты активности fионов. 

f(H2PO4 — ) =0,81. f( HPO4 2- ) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 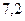 +lg
+lg 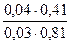 = 7,03.
= 7,03.
Пример 3. Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76.
Ионную силу раствора точно определить заранее нельзя, так как неизвестно количество и концентрация сильного электролита в полученном растворе. Однако можно создать требуемую ионную силу введением инертного электролита типа NaCl, Na2SO4. Для определенности примем ионную силу равную I = 0,1.
Коэффициент активности нейтральных молекул можно принять равными 1. Коэффициент активности иона аммония при данном значении ионной силы равен 0,81.
pН данной буферной системы равно: рН = рКа(NH4 + ) + lg 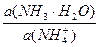
pKa(NH4 + ) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 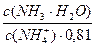
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 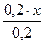 =x(моль/л) c(NH4 + )=
=x(моль/л) c(NH4 + )= 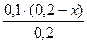 =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54 = 9,24 + lg 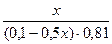 lg
lg 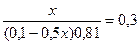
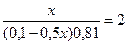 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 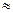 90мл.
90мл.
Пример 4.а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 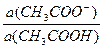
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 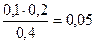 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу по концентрации сильного электролита:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем ввиду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН = 4,76 + lg 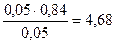
б) При добавлении соляной кислоты протекает реакция:
n(исх) 0,02 0,01 0,02 моль
n(прореаг.) 0,01 0,01 0,01 моль
n(оставш.) 0.01 0 0,03 моль
В растворе было:n(CH3COO — ) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 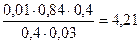
Буферная ёмкость по кислоте равна:
Bк = 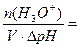
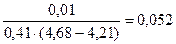 моль/(л.ед рН)
моль/(л.ед рН)
в) При добавлении щёлочи в буферную систему протекает реакция:
0,02 0,01 0,02 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН — заменяется в эквивалентных количествах на слабое (буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало: 0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 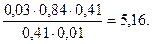
Буферная ёмкость по щёлочи равна: Вщ = 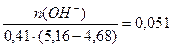 моль/(л . ед.рН)
моль/(л . ед.рН)
Пример 1.Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 — )= 7,2.
рН буферного раствора равно: рН = рКа + lg 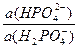
Определяем ионную силу раствора.
0,05 0,05 0,05 ( моль) 0,1 0,2 0,1 (моль)
Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л.
Концентрации ионов в буферном растворе равны:
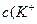 )=
)= 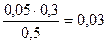 моль/л c(Na
моль/л c(Na  )=
)= 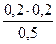 = 0,08моль/л
= 0,08моль/л
c(H2PO4 — )= 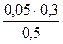 = 0,03 моль/л c(HPO4 2- )=
= 0,03 моль/л c(HPO4 2- )= 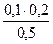 = 0.04 моль/л
= 0.04 моль/л
Ионная сила J= 0,5 ( 0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15.
По таблице находим коэффициенты активности f ионов. 

f(H2PO4 — ) =0,81. f( HPO4 2- ) = 0,41.Рассчитываем рН данного буферного раствора:
pH= 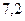 +lg
+lg 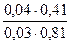 = 7,03.
= 7,03.
Пример 2 Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионная сила раствора J= 0,1.
Коэффициент активности нейтральных молекул можно принять равными 1,
а f(NH4 + ) = 0,81 в соответствии с ионной силой.
pН данной буферной системы равно: рН = рКа(NH4 + ) + lg 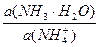
pKa(NH4 + ) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg 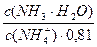
Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л.
c(NH3·H2O) = 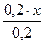 =x(моль/л) c(NH4 + )=
=x(моль/л) c(NH4 + )= 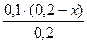 =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л.
Подставляем полученные данные в уравнение для рН буферной системы:
9,54 = 9,24 + lg 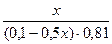 lg
lg 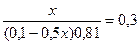
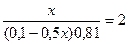 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл 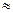 90мл.
90мл.
Пример 3а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76.
б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте.
в) Рассчитайте рН данной буферной системы после добавления
10 мл1М NaOH и буферную ёмкость по щёлочи.
а) рН ацетатной буферной системы равна: рН= 4,76 + lg 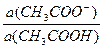
Концентрации буферных кислоты и основания равны:
c(CH3COO-) = с(СH3COOH) = 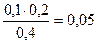 моль/л
моль/л
Для определения коэффициента активности определяем ионную силу:
J=0,5(0,05 + 0,05)= 0,05. 
Концентрацией ионов, которые даёт слабый электролит – уксусная кислота пренебрегаем в виду их малости.
Из таблицы находим коэффициенты активности ацетат – иона и иона натрия:f=0,84.
Рассчитываем рН буферной системы:
pН = 4,76 + lg 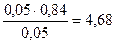
б) При добавлении соляной кислоты протекает реакция:
0,02 0,01 0,01 моль
В растворе было:n(CH3COO — ) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01·1 = 0,01моль.
При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия).
В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль,
а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль.
Поскольку количество ионов в результате такой реакции не меняется, ионная сила не изменяется и коэффициент активности остаётся прежним.
Тогда рН = 4,76 + lg 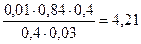
Буферная ёмкость по кислоте равна: Bк = 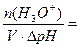
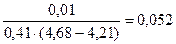 моль/л.
моль/л.
в) При добавлении щёлочи в буферную систему протекает реакция:
0,02 0,01 0,01 моль
В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01·1моль.
При этом сильное основание ОН — заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало:
0,02 + 0,01 = 0,03 моль. Поскольку ионная сила не меняется, коэффициент активности остаётся прежним 0,84.
Тогда рН = 4,76 + lg 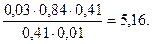
Буферная ёмкость по щёлочи равна: Вщ = 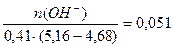 моль/л.
моль/л.
Дата добавления: 2014-12-27 ; Просмотров: 636 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Реакция среды в растворе конкретной БС зависит от двух факторов: Кдисс слабого электролита и соотношения компонентов. Значение рН БС может быть рассчитано по уравнению Гендерсона-Гассельбаха:
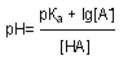
где рКа – показатель кислотности слабой кислоты (справочная, константная величина, например, для уксусной кислоты он равен +4,76), [A — ] – концентрация соли [HA] – концентрация слабой кислоты. Используя уравнение Гендерсона-Гассельбаха можно приготовить буфер с заданным значением рН.
Способность буфера к сохранению рН не беспредельна, она определяется концентрацией компонентов и их соотношением. Количественно эта способность характеризуется величиной буферной ёмкости.
Буферная ёмкость – это количество молей любой сильной кислоты или щёлочи, которое необходимо добавить к 1 л буферного раствора для смещения его рН на 1. Буферная ёмкость тем выше, чем больше концентрация компонентов и чем ближе их соотношение к единице.
Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет рН на единицу.
где В — буферная емкость,
С — концентрация кислоты или основания,
V — объем данного электролита,
Vбуф – объем буферного раствора ,
∆pH – изменение рН.
Буферная емкость зависит от ряда факторов:
1. Чем выше концентрации компонентов буферного раствора, тем больше его буферная емкость.
2. Буферная емкость зависит от отношения концентраций компонентов, а, следовательно, и от рН буфера. При рН=рКа буферная емкость максимальна.
3. Установлено, что достаточное буферное действие наблюдается, если концентрация одного из компонентов превышает концентрацию другого не более, чем в 10 раз.
Интервал рН=рКа±1 называется зоной буферного действия.
4. При разбавлении буферного раствора величина буферной емкости уменьшается вследствие снижения концентрации компонентов раствора.
Буферная ёмкость систем организма
| № | Буферные системы организма | Буферная емкость, моль/л |
| Вк | Вщ | |
| Гидрокарбонатная | ||
| Белковая | — | |
| Фосфатная | 0,5 |
Как следует из данных Таб. 4.2, буферная емкость по кислоте у буферных систем организма выше, чем буферная емкость по основанию. Это связано с особенностями метаболизма человеческого организма, образующего значительно больше кислотных продуктов, чем основных.
Механизм действия буферных систем
Механизм буферного действия рассмотрим на примере ацетатной БС: СН3СООН/СН3СОО — +Na + ,
где СН3СООН – слабая кислота, а СН3СОО — +Na + — соль, образованная сильным основанием (NaOH).
а) сильной кислоты (избытка протонов) ацетат-анион связывает этот избыток протонов (т.е. проявляет свойства основания) с образованием эквивалентного количества слабой уксусной кислоты:
Несмотря на увеличение общей кислотности, активная кислотность вырастет мало, так как оно произошло за счёт увеличения концентрации слабой кислоты, степень диссоциации которой понизится согласно закону Оствальда.
б) сильного основания (щёлочи, избытка ОН — -анионов) она нейтрализуется за счёт резервной кислотности:
Активная кислотность при этом изменяется незначительно, так как согласно закону Оствальда уменьшение концентрации слабой кислоты приводит к росту степени её диссоциации.
Обратите внимание, что катион металла, входящего в состав соли, не принимает участие в буферном действии.
При разбавлении и концентрировании рН не изменяется, так как остаётся прежним соотношение компонентов БС.
Буферные системы крови: гидрокарбонатная, фосфатная,
Гемоглобиновая, белковая
Бикарбонатная (гидрокарбонатная) БС (Н2СО3/НСО3 — ) – мощная система плазмы крови, составляющая примерно 10% от её общей буферной ёмкости. В норме соотношение компонентов (гидрокарбонат-анион / угольная кислота) равно 20.
Механизм действия бикарбонатной БС в организме аналогичен таковому ацетатной БС, с той лишь разницей, что при увеличении концентрации угольной кислоты, она интенсивно разлагается под действием фермента карбангидразы: Н2СО3 ↔ Н2О + СО2↑.
Образующийся при этом углекислый газ удаляется с выдыхаемым воздухом.
Фосфатная БС. Образована двумя ионами: гидро- и дигидрофосфат-анионами: НРО4 2- /Н2РО4 —
Первый из них выполняет роль соли, второй – слабой кислоты. На долю фосфатной БС приходится примерно 1% буферной ёмкости крови. Механизм её действия аналогичен описанному выше.
Белковая БС имеет меньшее значение в поддержании рН. Благодаря амфотерным свойствам белков, состав белковой БС условно можно представить, как белок-кислоту (НООС–Pr–NH3 + ) и белок-основание ( — ООС–Pr–NH2), где Pr – протеин (белок). При добавлении в систему протонов они последовательно будут связываться с оснόвными группами:
При добавлении в систему гидроксид-ионов они последовательно будут нейтрализоваться протонами, отщепляющимися от кислотных групп:
Гемоглобиновая БС – самая мощная в организме. Она действует в эритроцитах, обеспечивая примерно 76% буферной ёмкости крови. Она состоит из 2 сопряжённых кислотно-основных пар:
где HHb – дезоксигемоглобин, K + +Hb — — его калиевая соль; H + + HbO2 — — оксигемоглобин, являющийся более сильной кислотой, чем дезоксигемоглобин, а K + +HbO2 — — калиевая соль оксигемоглобина. Действует гемоглобиновая БС согласованно в периферических тканях и лёгких. В лёгочных капиллярах при высоком парциальном давлении кислорода гемоглобин на 98% насыщается кислородом, образуя оксигемоглобин. Оксигемоглобин как более сильная кислота, чем угольная, вытесняет её из гидрокабонат-аниона, поступающего из периферических тканей. Выделившаяся угольная кислота под действием фермента карбангидразы разлагается на воду и углекислый газ, удаляемый с выдыхаемым воздухом: HHb + О2 → H + + HbO2 —
В капиллярах периферических тканей, при низком парциальном давлении кислорода последний освобождается и используется в процессах биологического окисления. Дезоксигемоглобин, будучи более слабой кислотой, чем угольная, образует молекулярную форму:
Источником протонов и гидрокарбонат-анионов является угольная кислота, образующаяся в периферических тканях из продуктов метаболизма – воды и углекислого газа. Следует обратить внимание, что гемоглобиновая БС является плазменно-клеточной и действует совместно с бикарбонатной.
Последнее изменение этой страницы: 2017-02-05; Нарушение авторского права страницы